
第二種再生医療等提供計画番号
PB3170022(脳血管障害治療)
PB3200051(脊髄損傷治療)
PB3170032(変形性膝関節症治療)
PB3200020(皮膚の加齢性変化治療)
PB3240063(糖尿病治療)
PB3240064(慢性疼痛治療)
PB3240264(毛髪再生治療)
細胞加工施設届出番号 FC3170010
治療メニューmenu
自己骨髄由来間葉系幹細胞を用いた脊髄損傷治療
当院では再生医療である幹細胞治療を行えるよう、厚生労働省に再生医療等提供計画書を提出し、受理されました。
■第二種再生医療等提供計画番号 PB3170023BTRアーツ銀座クリニック内クリーンルーム
厚生労働省届出番号
■細胞加工施設届出番号 FC3170010
【脊髄損傷再生医療】に関しての再生医療等提供計画書を提出し受理されました。
再生医療等の意義
概要
当院の脊髄損傷治療・麻痺回復治療は、中枢神経に障害を持つ患者様に対し、血管新生や神経再生効果によって症状を改善する目的で、患者様自身の腸骨から間葉系幹細胞(mesenchymal stem cells;MSC)を採取して必要な細胞数培養した後、静脈内に投与する治療法です。
当該再生医療では幹細胞等の細胞と、それらの細胞が産生するサイトカインや成長因子が、損傷した組織の修復や改善を行うと考えられています。
また、一部の研究では幹細胞それ自体も組織の修復に関与する可能性が示唆されています。
この脊髄損傷治療・麻痺回復治療で投与する細胞の数は、患者様の年齢や症状の度合いによって異なりますが、静脈投与1回あたり0.5億個~1億個としています。
投与後1、3、6ヵ月後に経過観察を行います。基本的には1回の治療で十分な改善効果が期待できますが、ご希望と医師の判断によっては2回目の治療をおこなうこともあります。
当院で可能な治療可能な対象疾患等
中枢神経障害患者様・脊髄損傷による麻痺がある患者様
幹細胞とは
間葉系幹細胞(mesenchymal stem cells;MSC)は、骨髄や脂肪組織などから容易に採取・分離できる未分化細胞であり、造血支持組織として骨髄間質を構成する細胞成分に分化するだけでなく、脂肪細胞・骨細胞・軟骨細胞・筋細胞・腱など、中胚葉系のさまざまな組織に分化する能力をもった細胞です。
過去の研究にて幹細胞治療効果が示唆されている疾患
- 血管の病気
- 心筋梗塞、脳梗塞、腎不全初期、認知症、糖尿病などの下肢の虚血、その他血管が病気になってくる病気全般
- 神経の病気
- 小児麻痺、認知症、脳梗塞、パーキンソン、その他
- 骨・軟骨の病気
- リウマチ、変形性関節炎
- その他の疾患
- 糖尿病、肝臓病、免疫疾患(難治性の膠原病)、ぜんそく等
- 予防的効果
- 疾病の予防、体全体の機能向上など
幹細胞の静脈内投与による脊髄損傷治療・麻痺回復のメカニズム
幹細胞には、損傷部位を自動的に認識してその場所へ集結し、損傷組織の修復を促す特性があります。
本治療では、患者様本人の脂肪組織から採取、培養した幹細胞を静脈内に投与することで、血流にのって傷ついた部位に集まった脂肪由来間葉系幹細胞から分泌される栄養素の作用により血管新生作用、脳血流改善、神経再生・保護等などの機能回復が期待される他、幹細胞の抗炎症作用により、炎症を鎮静化し、痛みや不調の原因を緩和します。
起こりうる副作用
・骨髄液採取手術に伴い、出血、創部の感染、傷跡やヒキツレなどが起こることがあります。
・幹細胞静脈投与による肺梗塞が発生する可能性があります。診断リスクが高いと判断された場合には、治療をお断りする場合があります。症状に合わせて各種検査を受けて頂くことがあります。
治療の流れ
-

事前準備
患者様が治療対象となるか、安全に治療を受けて頂けるか事前判断を行います。診療情報提供書(今までの治療経過を纏めた紹介状)、発症部位のMRI、服薬情報など必要な資料を事前送付して下さい。治療可能と判断されましたら、初診カウンセリングのご予約に進みます。 紹介状などのご用意が難しい場合はご相談ください。資料が揃っていなくてもカウンセリングが実施できる場合もあります。
-
1. 初診日
既往歴、服薬、リハビリ状況など詳細な治療状況をもとに専門医とのカウンセリングをおこないます。期待される効果や考えられるリスクなど丁寧に説明します。
-

2. 血液検査
感染症の検査を行います。結果が出るまでに1週間ほどかかります。お急ぎの場合には、初診日に検査を実施することも可能です。感染症が見つかった場合には、専門の培養コースが必要となります。
治療を開始するには、血液検査に加えて胸部レントゲン、心電図の検査データも必要となります。
血液検査項目はこちらです。 -
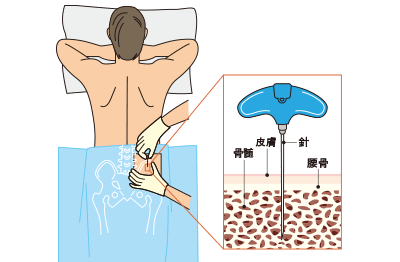
3. 骨髄液採取
局所麻酔を使用し、腰の腸骨より骨髄液を採取します(約10ml)。採取後は当日にお帰り頂けます(当日の入浴は避けて下さい)治療費は採取日に全額お支払い頂きます。
※遠方にお住まいの方は、当日の移動を避けて東京での後泊をお願いしております(当院には入院施設はありません) -
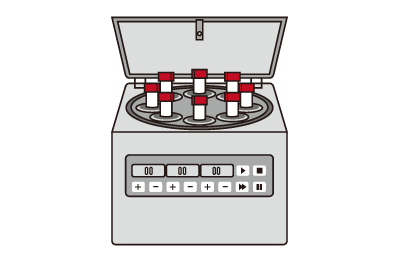
4. 幹細胞の培養
院内の専用施設にて、骨髄液から幹細胞を分離して培養を行います。培養期間は概ね3週間となります。
-
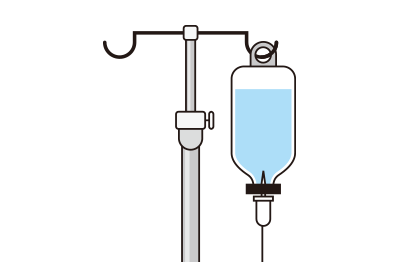
5. 幹細胞の投与
点滴により幹細胞を投与します。2時間程度の施術となります。投与された幹細胞は体内を巡り、損傷部位へ集まり脊椎神経の再生が期待できます。
-

6. 術後診断
投与後、1ヶ月、3ヶ月、6ヶ月後を目安に定期検診を行い、症状の改善状況と安全性を確認します。治療効果を比較検証するために、術後のMRI、CTデータをお持ち頂けるようにお願いしております。
治療後のフォローアップについて
本治療の安全性と有効性の確保の為、治療後1ヶ月、3ヶ月及び6ヶ月に、一般的な問診と、来院時までに患者様が何らかの病気になった(なっていた)かについて確認します。
また、患者様アンケートを行い、治療後に症状が改善しているか、日常の生活にどのような変化があったか、リハビリ状況を確認します。
複数の評価方法を用いて治療の有効性を検討し、場合によってはCTまたはMRI撮影を行い、術前術後の比較検討をします。
期待される効果
中枢神経は脳と脊髄にて構成されており、全身に指令を送る神経系統の中心的な働きをしています。
この中枢神経がダメージを受けると、筋力の低下や麻痺、感覚の異常や喪失が起きるほか、排尿や排便の調節が困難となることもあります。
本再生医療にて使用する間葉系幹細胞は、骨、軟骨、筋肉、腱、脂肪、神経など、多様な細胞に分化できる能力を持つことから、傷ついた組織の修復や機能回復、血管新生(脳血流改善)作用を誘発させ、中枢神経障害における日常生活動作障害、機能障害の改善が期待されます。
患者様の適格性確認
患者様は、次に掲げる基準を満たす方に限ります。
- インフォームド・コンセントを受けている方
- この治療について十分な理解が得られている方
- 臨床検査(血液検査)の結果、総合的に判断して重篤な機能不全の所見が見られない方
- 感染症を有していない方
- 薬物過敏症の既住歴のない方
- 16歳以上90歳以下の方
病原性微生物検査(HIV、HBV、HCV、HTLV-1、梅毒血清反応)が陽性の方は専用の隔離培養が必要となり、差額のご負担をお願いしております。
治療にかかる費用について
(税込価格)
| カウンセリング カウンセリングは納得がいくまで何度でも可能ですが、その都度料⾦が発⽣致します。 |
初回 | 3,300円 |
|---|---|---|
| 2回⽬以降 | 1,650円 | |
| WEBカウンセリング | 5,500円 | |
| 術前⾎液検査 培養の可否判断に必要となります。遠隔地の⽅は地元で検査受けて頂き結果をお送り頂く事でも対応可能です。その場合には検査費⽤は発⽣致しません。 |
⾎液検査 | 10,560円 |
| CT、MRI撮影 MRI、CTの画像を元に、症状を確認し施術の可否を判断致します。施術後にも経過確認のためにMRI、CT画像の提供をお願いしております。 |
ご⾃分がかかりつけの病院にて受診 | ⾃⼰負担 |
| 幹細胞治療 施術 ○幹細胞採取 ○幹細胞培養 ○3週間後以降の投与施術 通常では1回の幹細胞投与にて効果が期待できます。 |
1回 | 1,650,000円 |
| 術後定期診察 1ヶ⽉後、3ヶ⽉後、6ヶ⽉後を⽬安として計3回となります。 |
1回 | 1,650円 |
モニター制度のご案内
術前術後の比較テスト撮影と公開にご協力頂くことで、治療費を大幅に減免するモニター制度も御座います。モニター対象となった場合には、基本施術代を104.5万円(税込)で受けて頂けます。
海外の患者様へ
外国人患者の方が当院での受信・相談を希望される場合には、円滑で安全な診療を行うため、原則として医療コーディネート会社を介して、手続きを行っていただくことになります。
治療料金はコーディネート会社の規定によりますので、直接コーディネート会社様へお問い合わせ下さい。
お支払いについて
- 保険適応外となります。
- 幹細胞治療 施術代は、脂肪採取日に全額お支払い頂きます。
- 表⽰価格は全て税込となっております。
- 費用に関してご不明な点は、当院までお気軽にお問い合せくださいませ。
- 再生医療のお支払いには、各種クレジットカードの利用や医療ローンをお選び頂く事も可能です。
利用可能なクレジットカードは、Visa、Master、JCB、銀聯、アメックス、ダイナースとなっております。
医療ローンに関しては、ローン会社による審査が必要ですので、必ずしもご希望に添えない場合があります。
キャンセルや変更について
(税込価格)
| 採取⽇より10⽇以内のキャンセル | 330,000円のみご負担頂き、残⾦は返⾦致します |
|---|---|
| 採取⽇より11⽇以降のキャンセル | 100%ご負担頂き、返⾦は致しかねます |
| 培養しても幹細胞の増殖が認められない場合 | 165,000円のみご負担頂き、残⾦は返⾦致します |
| 投与⽇決定後の⽇程変更に関して | 1回の変更に付き、110,000円の再培養費⽤が追加されます |
感染症をお持ちの方へ
当院では、感染症(B型肝炎、C型肝炎、梅毒、HIV、成人T細胞白血病)をお持ちの方にも再生医療を受けて頂けるように、専用の培養室、医薬品、器具、医療機器を用いた培養を開始致しました。投与前には、培養した幹細胞にたいする遺伝子検査も実施し、安全な再生医療の提供を目指しております。
専用の培養となるために、追加費用として165,000円の実費のご負担をお願いしております。複数の感染症に罹患されている場合には 、1疾患ごとに44,000円の追加遺伝子検査費用のご負担をお願い致します。
感染症の患者様の場合には、培養期間が通常よりも長くなる場合もあります。カウンセリングにてご確認下さい。
その他特記事項
健康状態把握の為、本治療を受けてから1ヶ月、3ヶ月及び6ヶ月後の定期的な通院と診療にご協力をお願いします。定期的な通院が困難である場合は、電話連絡などにより経過観察をさせて頂きますので、お申し付け下さい。また、幹細胞治療を受けられたすべての患者様に術前術後の診療時に施術部位の撮影を行っております。併せてご協力をお願いします。
以下の罹患している疾患・および治療の為に服用されている薬の影響で、細胞の増殖が遅くなる場合や増殖しない場合があります。
(①バセドウ病②橋本病③抗がん剤④美容サプリメント⑤抗凝固剤を多用服用されている方⑥血液クレンジングをされている方)
BTRアーツ銀座クリニック
BTR Arts Ginza Clinic

〒105-0004 東京都港区新橋2-20-15 新橋駅前ビル1号館201
【開局時間】月・火・木・金 11:00~19:30 / 土 10:30〜19:00
【休診日】毎週日曜日 / 毎週水曜日







